学习植物内源激素的提取、分离和纯化方法,并掌握溶剂萃取植物激素的基本原理。
1.原理
目前已知的植物激素有生长素(IAA)、赤霉素(GA)、细胞分裂素(CTK)、脱落酸(ABA)和乙烯(Eth)5大类。利用各种激素的理化性质不同,例如在溶剂中的溶解性,极性或者在不同pH条件下的溶解度等,可以将植物激素从新鲜样品中提取出来,采用溶剂萃取、薄层层析、C18胶柱(Sep-PakC18Cartridge)分离等技术对其进行进一步的分离和纯化。
当用两种互不相溶的溶剂萃取时,由于各种激素在不同溶剂中及不同pH时的分配系数不同,使之从一种溶剂转移到另一种溶剂。例如中性激素,依据它在有机相与水相的分配系数,选择适当的有机溶剂萃取,活性物质便进入有机相、糖和有机酸等留在水相;当pH调至酸性(pH 2.8-3.0)时,酸性激素(如ABA、IAA、GA),则呈分子态而易溶于有机相。细胞分裂素为碱性物质,用1 mol•L-1 NaOH调pH到碱性(pH8.0)时,即可进人有机相;而杂质留在水相,从而得到初步分离纯化。
应用离子交换树脂进一步分离纯化,便得到较纯的样品。一般酸性物质吸附在阴性树脂上,碱性物质吸附在阳性树脂上。选择适当的树脂与洗脱液,可以有效地将激素分离出来。最后通过层析分离,便可得到较纯的样品。
2.仪器设备
1.冰箱。
2.冰浴盒。
3.研钵。
4.离心机。 5.小试管。
6.烧杯。
7.容量瓶。
8.紫外灯。
9.氮气干燥装置、减压蒸馏装置等。
3.试剂
| 1.95%甲醇。 | 2.80%甲醇。 |
| 3.石油醚。 | 4.1.0 mol•L-1柠檬酸。 |
| 5.聚乙烯吡咯烷酮(PVP)。 | 6.1.0mol•L-1乙酸乙酯。 |
| 7. Dowex50。 | 8.3 mol•L-1氨水。 |
| 9.95%乙醇。 | 10.0.1mol•L-1柠檬酸-磷酸缓冲液。 |
| 11.1.0 mol•L-1 NaOH。 | 12.饱和正丁醇。 |
4.材料
各种新鲜植物组织。
5.方法步骤
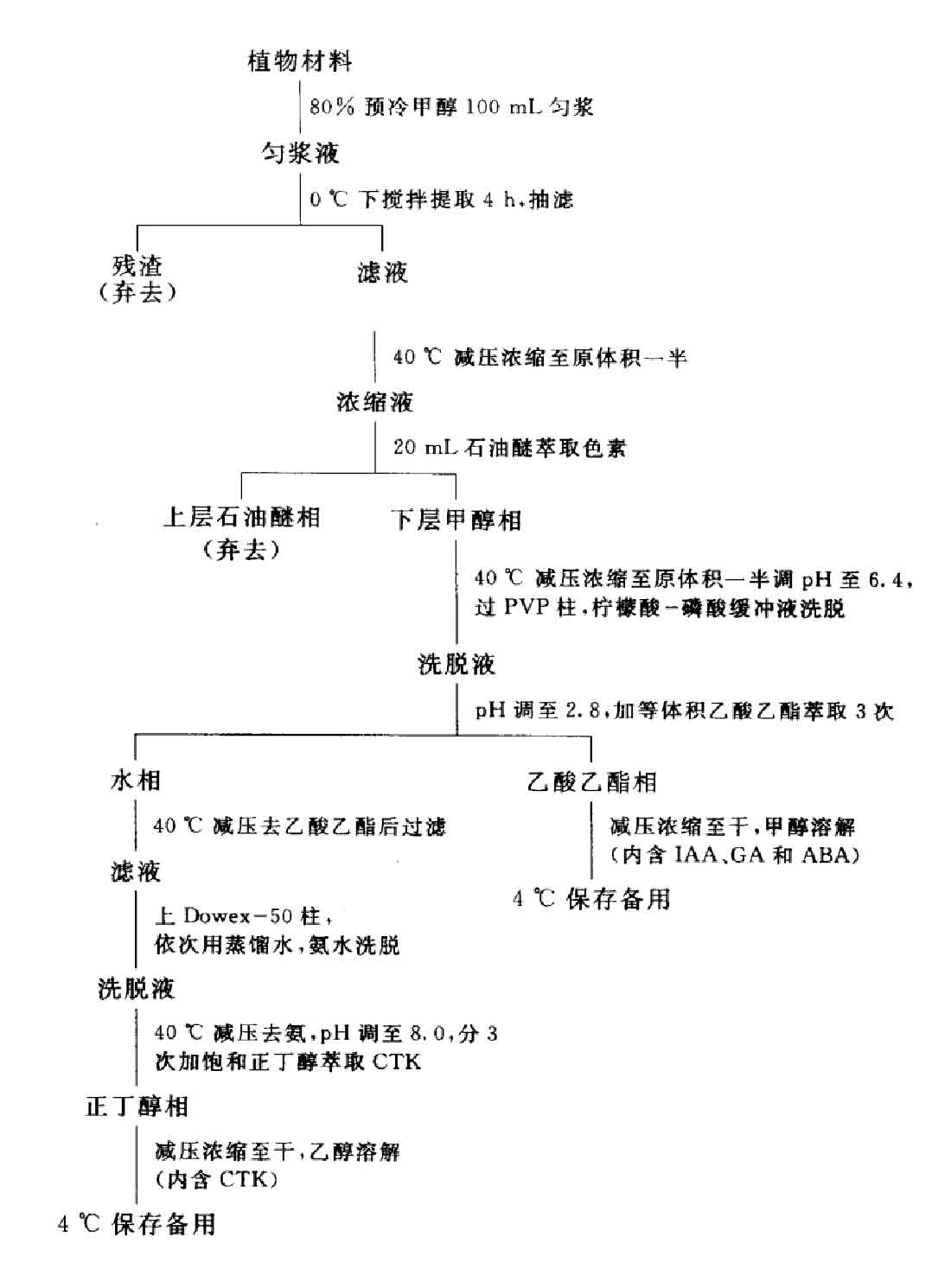
1.样品提取:称取玉米黄化幼苗25 g,剪碎后加入在0℃下预冷的95%甲醇(或95%冷丙酮)100mL,匀浆5min,匀浆液在0C下避光搅拌提取4h,过滤,滤液置冰箱中保存;残渣用30mL80%冷甲醇重复提取2次,每次搅拌1h,将滤液合并后在40℃下减压浓缩至原体积的1/2,加入20 mL石油醚萃取色素。弃去上层石油醚色素溶液,将下层甲醇溶液继续减压浓缩至水相(约35 mL) ,在此水相中含IAA、GA、ABA和CTK等。
2.分离和纯化
(1) PVP过滤:用0.1 mol•L-1柠檬酸将浓缩液的pH调至6.4,然后过PVP柱(高约4 cm),过滤完后,用20mL 0.1 mol•L-1柠檬酸磷酸缓冲液洗柱,并将洗涤液与滤液合并。
(2)溶剂萃取:将过PVP柱的滤液用1.0 mol•L-1的柠檬酸调pH至2.8,加入等体积的乙酸乙酯萃取3次,合并萃取液,保留水相。此时,IAA.GA、ABA存在于乙酸乙酯中,而CTK存在于水相中。
(3)将乙酸乙酯溶液在40℃下减压浓缩至干后,用2mL甲醇溶解残留物(内含IAA、GA和ABA),并于冰箱中保存备用。
(4)将(2)中含有CTK的水相溶液在40℃下减压蒸去残留的乙酸乙酯,过滤。将滤液的pH调至2.8后上Dowex50柱。先用50 mL蒸馏水洗柱,再用50 mL 3 mol•L-1氨水洗脱。收集洗脱液,减压浓缩至无氨,将剩余溶液用1 mol•L-1 NaOH调pH至8.0,并用等体积的饱和正丁醇萃取3次,合并萃取液,40℃下减压蒸馏除去正丁醇,用2 mL95%乙醇溶解残留物,于冰箱中保存备用(内含CTK)。
以上提取、分离、纯化步骤归纳于图1-1。
独立公正 方法科学 规范严谨 服务周到

