所有绿色植物都含有色素,以进行光合作用。因而测定水样中色素的含量,也是一个对浮游植物的定量方法。
各门藻类虽具有不同的色素组成,但都含有叶绿素a。叶绿素a不仅含量高,而且最重要,是整个光合作用过程中的能量传递中心。因此,主要以叶绿素a值作为浮游植物现存量的指标。
由于叶绿素测定法比计数法简便和快速,目前已成为一个常用的测定浮游植物现存量的方法。同时,叶绿素值通过一定的换算,也可指示初级生产量的大小。
用于测定叶绿素的水样的采集方法与用于浮游植物数量测定的相同。采集的水样可根据水中浮游植物含量的多少确定,一般采用0.5-2升,如浮游植物含量特别低,需增加水样量。
水样注入水样瓶后,应避免阳光直射,放在荫凉处。如水样的进一步处理需经较长时间(例如在次日),则应该置低温(-4℃)保存,并加入1%碳酸镁悬浊液,每升水样中加1毫升,以防止酸化。
安装好抽滤设备——包括砂芯过滤装置(直径50毫米的)、抽滤瓶、负压表、真空泵等。在滤器中放入滤膜。滤膜用玻璃纤维滤膜或混合纤维酯微孔滤膜(孔径0.8微米)。前者过滤速度快,需过滤水样量大时,应优先采用。如水样中未放碳酸镁液,应在滤膜上先抽滤约0.5-1毫升的碳酸镁液以防止酸化。抽滤时负压应不大于0.5大气压(50千帕)。
抽滤完毕后,用镊子小心地取下滤膜,将其对折(有浮游植物样品的一面向里),再用普通滤纸吸压,尽量去除滤膜水分。如不立即提取,应将滤膜放在黑暗低温条件下保存。在普通冰箱冷冻室可保存几天;在-20℃低温冰箱中可保存30天。
样品先经研磨,可提高色素提取效果。研磨可用玻璃研钵或玻璃匀浆器。将滤膜剪碎,放入研钵或匀浆器,加入7-8毫升提 取剂,研磨几分钟。将研磨后的匀浆物移入具塞带刻度的离心管中。用少量提取剂冲洗研钵或匀浆器,冲洗液并入离心管中,使最终容积略小于10毫升。盖上管塞,摇动后置黑暗低温处。
提取液可用90%丙酮、90%或100%甲醇、90%乙醇等。一般最常用的是丙酮。近年来国际上有关专家通过研究试验,从提取效率、安全、保健等考虑,建议今后不使用丙酮,而改用乙醇作提取剂。我国多年来大多使用丙酮,考虑到资料的可比性,目前仍可继续使用。
提取时间应不少于6小时(乙醇或甲醇)或20小时(丙酮),不多于24小时。
将装有提取液的离心管放入离心机中,在转速3500-4000转/分下离心10-15分钟。将上层叶绿素提取清液移入定量试管中,再用少量丙醇悬浮沉淀物并离心取得提取清液。重复1-2次。最后将提取液定容到10毫升。
在一定光径(1-3厘米)的比色m中读取波长为665和750纳米处的光密度。750纳米处的光密度是作为校正其他物质的吸收值用,参比液(提取剂空白)和样品液间的750纳米光密度值之差应不大于0. 005。665纳米处光密度值应在0.1-0.8之间。
加1滴HCI液到比色皿中,在1-15分钟内再次测定750和665纳米处的光密度。
分光光度计的波长精度和光谱带宽对测定结果有较大影响,应注意采用适合的光度计。
按下列公式计算:

式中C——水样中叶绿素a的含量(毫克/米3或微克/升);
Pa——水样中脱镁叶绿素的含量(毫克/米3或微克/升);
Eb——提取液酸化前波长665纳米和750纳米处的光密度之差;
Ea——提取液酸化后波长665纳米和750纳米处的光密度之差;
R——最大酸比,即不含脱镁叶绿素的纯叶绿素a提取液在酸化前后光密度比值,R=Eb/Ea,目前采用R值为1.7;
K——叶绿素a在665纳米处的比吸光系数的倒数乘以1000.根据目前资料,比吸光系数在90%丙酮中一般取89,在90%乙醇中取87,在100%甲醇中取77,故K值相应为11.24,11.49和12.99;
Ve——提取液的总体积(10毫升);
V——抽滤的水样体积(升);
I——比色皿的光径(厘米)。
因上式中R和K值为已知,如用90%丙酮作提取剂,比色皿光径为1厘米,则上述计算公式可简化为:
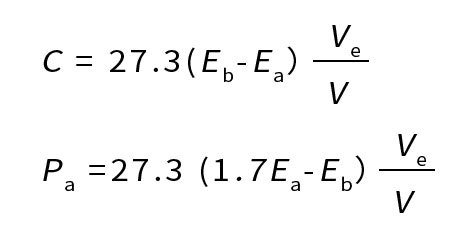
分光光度法的测定极限为1微克/升,如果水中叶绿素含量极低(如贫营养型湖泊水库和海洋),则要用荧光法测定,它的灵敏度至少比分光光度法要提高10倍。
浮游植物的生物量还可通过测定其他化学成分,如碳、氮、磷、蛋白质、,酶、ATP等来求得,但这些方法都还存在不少问题,较难普遍采用。
独立公正 方法科学 规范严谨 服务周到

