高等植物根系吸收的无机氮素主要是硝态氮和铵态氮。根系吸收的硝态氮可以通过木质部转移到地上部去,也可以贮藏在根细胞液泡中,也可以在根部被同化为氨基酸,也可以进入到细胞间隙。植物对硝态氮的吸收一般是奢侈吸收。植物体内硝态氮的含量往往能在一定程度上反映土壤中硝态氮的供应情况。所以测定植物体内硝态氮含量变化对了解氮代谢机制及其土壤中无机氮素的丰缺都是很重要的
1.原理
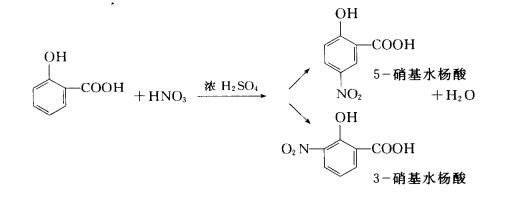
在浓酸条件下,NO3-与水杨酸生成硝基水杨酸。硝基水杨酸在碱性条件下(pH>12)呈黄色,可以在410nm波长下测定其吸光度。反应如下:
2.试剂
(1).标准溶液(0.5 mg NO3- -N·mL-1):准确称取烘干恒重的KNO3(AR)0.1631g,溶于去离子水中并定容200mL。
(2).5%水杨酸-硫酸溶液:称取5g水杨酸,溶于100mL浓硫酸(相对密度1.84)搅拌溶解后贮于棕色瓶中,冰箱中保存一周内有效。
(3).8%NaOH:称取8g NaOH,溶于100mL去离子水中。
3.方法步骤
3.1.制作标准曲线
(1)不同浓度NO3- -N的配制:取7个50mL容量瓶,编号,按下表加入试剂后,即得到0、20、40、60、100、120 μg/mL的NO3- -N系列浓度。
| 编号 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.5 mg·NO3- -N/mL 母液用量/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| 无离子水/mL | 50 | 48 | 46 | 44 | 42 | 40 | 38 |
| NO3- -N最终浓度/(μg·mL-1) | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
(2)标准曲线制作:取7支试管,标号分别为:0、1、2、3、4、5、6.将上表的标准溶液各吸取0.1mL,加入下表相应标号的试管中。然后按下表加入试剂及操作,记录吸光度。
3.2.样品中硝态氮含量的测定
| 编号 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 表1试剂用量 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
| 摇匀,室温下放置20min | |||||||
| 8%NaOH用量/mL | 9.5 | 9.5 | 9.5 | 9.5 | 9.5 | 9.5 | 9.5 |
| 上下颠倒混匀,冷至室温后,测定410nm处的吸光度A410,记录在下栏。 | |||||||
| 每管中NO3- -N含量/μg | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
(1)样品液的制备:取欲测定的样品叶片或根系,洗去灰尘和泥土,擦干后,将同一处理样品剪碎,混匀,准确称取0.5-1g(重复3次),放入刻度试管中,准确加入10mL无离子水,用塞子堵住试管口,在沸水浴中提取30min,取出后,用流水冷却。将提取液过滤在25mL容量瓶中,用少量去离子水多次冲洗提取残渣,冲洗液并入容量瓶中,最后定容至25mL。
(2)样品液测定:吸取0.1mL样品液,放入试管中,其余步骤同上表。重复三次。
4.结果计算
将测定的样品液的吸光度代入到标准曲线方程式中,计算出相应的硝态氮含量,然后按下式计算植物组织硝态氮含量:
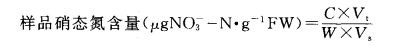
式中,C:标准曲线计算的NO3- -N值(μg);Vt:样品提取液总体积(mL);W:样品重量(g);Vs:测定用样品液体积(mL)。
5.注意事项
水杨酸和硝态氮的反应时间不能少于20min。
独立公正 方法科学 规范严谨 服务周到

