一、原理:
植物组织中的还原糖、蔗糖等在80%的乙醇溶液中溶解,而淀粉及大部分蛋白质沉淀,当用4.6 mol•L -1高氯酸(HCIO4)溶解淀粉后,也可使蛋白质、纤维素等沉淀,再以0.1 mol•L -1NaOH溶解蛋白质、热水和丙酮除去果胶和脂质后,剩余的沉淀可用于纤维素含量的测定。将上述各部分分离后,再选用适当的方法分别测定。
本实验选用3,5-二硝基水杨酸法测定还原糖,蔥酮法测定可溶性总糖、淀粉和纤维素含量。其原理分述如下:
1.还原糖测定:各种单糖和麦芽糖等还原糖在碱性条件下,与3,5-二硝基水杨酸试剂共热时,可将黄色的3,5-二硝基水杨酸还原为棕红色的氨基化合物。在一定范围内还原糖的量与反应液颜色的深浅成正比。利用分光光度计在540nm波长下测定反应液的吸光度,查对标准曲线或利用一元回归方程计算出还原糖的含量。
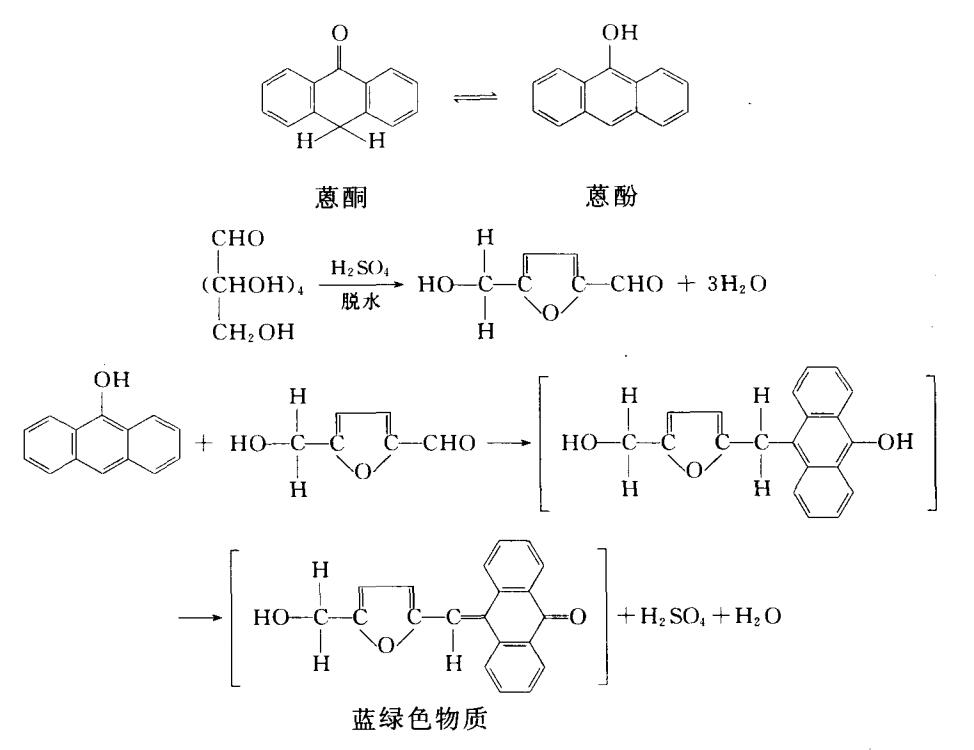
2.蒽酮比色法原理:糖(包括可溶性糖和多糖)在浓H2SO,作用下脱水形成糠醛,再进一- 步脱水形成环后,产生糠醛衍生物,可与蒽酮脱水缩合而成蓝绿色物质。在620 nm处有最大吸收,而且在10~100 μg范围内其颜色深浅与糖含量呈正比。此法适用于己酮糖和己醛糖的测定。
加热时间和温度影响蒽酮反应的颜色深浅,因此操作中应保持反应条件的一致。同时样品中含有较多的色氨酸时反应不稳定。
二、仪器设备
| 1.离心机。 | 6.铝试管架。 |
| 2.分析天平。 | 7.分光光度计。 |
| 3.三用水浴。 | 8.沸水浴。 |
| 4.容量瓶。 | 9.移液管。 |
| 5.10 mL离心管。 | 10.15-25mL具塞试管8支、18X180mm试管12支。 |
三、试剂
1.80%乙醇溶液。
2. 9.2 mol•L -1及4.6 mol•L -1高氯酸(HCIO4)。
3. 0.1 mol•L -1 NaOH溶液。
4.60% H2SO4。
5.葡萄糖标准液:称取分析纯葡萄糖(预先于80°C下烘干至恒重)100mg,溶于蒸馏水中,定容至100mL,即为1mg•mL -1标准原液,用时稀释10倍,即为100μg•mL -1标准液。
6.蒽酮一硫酸试剂:称取0.2g蒽酮,和1.0g硫脲(抗氧化剂)置烧杯中,缓缓加人100mL浓硫酸,搅拌溶解后应呈淡黄色透明溶液,随配随用。
7. 3,5-二硝基水杨酸试剂:精确称取1g 3,5-二硝基水杨酸,溶于20mL 2mol•L -1NaOH溶液中,加入50mL蒸馏水,再加入30g酒石酸钾钠,待溶解后用蒸馏水定容至100mL。盖紧瓶塞,勿使CO2进入。若溶液浑浊可过滤后使用。
8.纤维素标准液:准确称取纤维素100mg,在冰浴下加人60~70mL预冷的60%H2SO4,在0~2°C下水解12h;然后用60% H2SO4稀释至100mL刻度,摇匀。将此液在冰浴下稀释10倍,即可100μg•mL -1之标准液。
四、材料
过100目筛的植物干样品或新鲜植物组织。
五、方法步骤
1.提取分离
(1)称取植物干样0.5000g于10mL离心管中,加入5~6mL80%乙醇溶液,80°C水浴30min ,其间不时搅拌。用少量80%乙醇冲洗玻璃棒,并将溶液冷却到室温后3500g下离心10min,上清液转入25mL容量瓶中;再向沉淀中加入5-6mL80%乙醇,如上法重复浸提2次,将上清液合并于25mL容量瓶中,并定容至刻度。该提取液用于测定还原糖和可溶性糖。
(2)向沉淀中加人2 mL蒸馏水,在沸水浴中糊化15 min,冷却后加人2 mL 9.2 mol•L -1HCIO搅拌15 min后,加蒸馏水4mL,混匀,在4000g下离心10 min,上清液转入50 mL容量瓶中。再向沉淀中加人2 mL 4.6 mol•L -1HCIO, ,搅拌提取15 min,加入5 mL蒸馏水,混匀后离心10min,合并上清液,用蒸馏水洗沉淀2次,每次5~6mL,合并上清液并用蒸馏水定容到刻度。该提取液用于测定淀粉。沉淀用于纤维素的测定。
(3)依次用0.1mol•L -1NaOH溶液、热蒸馏水和丙酮等各洗沉淀2~3次,以除掉蛋白质、果胶和脂质等杂质。每次洗15min,溶剂用量5-6mL,离心后弃去上清液;沉淀用于纤维素含量测定。
(4)向洗涤后的沉淀中加人5~6 mL 60%的H2SO4溶液,搅拌均勾后置4°C冰箱中冷水解12h以上,取出后于4000g下离心15 min,上清液转人25 mL容量瓶中;再向沉淀中加入5-6 mL 60%的H2SO4溶液,重复提取2次,每次15 min,将上清液合并于25 mL容量瓶中,并用60%H2SO4定容至刻度,用于粗纤维含量测定。
2.测定
(1)还原糖的测定
①制作标准曲线:取7支25mL具塞刻度试管编号,并按下表加入各种试剂。
| 试剂 | 试管号 | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 1mg•mL -1葡萄糖标准液/mL | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.2 |
| 蒸馏水/mL | 2.0 | 1.8 | 1.6 | 1.4 | 1.2 | 1.0 | 0 |
| 3,5一二硝基水杨酸/mL | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
| 葡萄糖含量/mg | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.2 |
加完试剂后摇匀,在沸水浴中加热5 min,取出后立即用流水冷却,加蒸馏水定容至20 mL。以1号管作为空白调零,在540 nm波长下比色测定。以吸光度为纵坐标,葡萄糖含量为横坐标,绘制或求出标准曲线。
②样品中还原糖含量的测定:吸取可溶性糖提取液2mL,置10mL离心管中(每个样品重复3次),在沸水浴上蒸干,准确加人10~20 mL蒸馏水(加水体积依还原糖含量而定),充分搅拌使糖溶解,离心,取2 mL上清液(剩余上清液用于可溶性糖测定)于试管中,加入2 mL 3,5-二硝基水杨酸试剂,与标准曲线同法测定之。
③结果计算
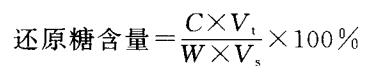
式中,C:从标准曲线上查得或计算出来的样品测定管中葡萄糖含量(mg);V.:样品提取液总体积(mL);V, :测定时取样体积(mL);W :样品干重(mg)。
(2)可溶性总糖的测定
①制作标准曲线:取6支25mmX180mm试管编号,并按下表加入各种试剂。
| 试剂 | 试管号 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 100μg•mL -1葡萄糖标准液/mL | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
| 蒸馏水/mL | 2.0 | 1.8 | 1.6 | 1.4 | 1.2 | 1.0 |
| 蒽酮-H2SO4试剂/mL | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 |
| 葡萄糖含量/μg | 0 | 20 | 40 | 60 | 8 | 100 |
在加蒽酮-H2SO4试剂时,最好将试管放在冰水浴中,并沿管壁缓缓加人,待全部加完后再混匀。将以上标准管和样品管同时放入100 C水浴中准确加热10 min,取出后用自来水冷却至室温后测定620 nm波长下(光径0.5 cm)吸光度。以吸光度为纵坐标,糖溶液浓度为横坐标,绘制标准曲线。
②样品测定:取上述测定还原糖剩余的样品液适当稀释(10~50倍)后取2mL与标准管同样操作,记录620nm波长下的吸光度。
③结果计算
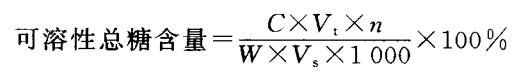
式中,C:从标准曲线上查得样品测定管中含葡萄糖的量(μg);n:稀释倍数;1 000:换算系数,1mg=1000μg;其他符号意义与还原糖计算中相同。
(3)淀粉含量的测定:取上述淀粉提取液2 mL于25 mmX180 mm大试管中,用测定可溶性糖的方法测定之。结果计算如下。
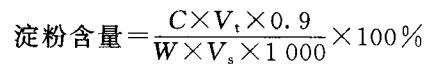
式中,0.9:葡萄糖换算成淀粉的系数;其余符号与可溶性糖计算相同。
(4)纤维含量的测定
①蒽酮-H2SO4法:按下表加入各种试剂并制作标准曲线:
| 试剂 | 试管号 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 100μg•mL -1葡萄糖标准液/mL | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
| 蒸馏水/mL | 2.0 | 1.8 | 1.6 | 1.4 | 1.2 | 1.0 |
| 蒽酮-硫酸试剂/mL | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 | 5.0 |
| 纤维素含量/μg | 0 | 20 | 40 | 60 | 80 | 100 |
以上标准管加完试剂后,先不摇动,再吸取2 mL水解液(重复3次),放入另一试管中,待全部加完蒽酮硫酸试剂后摇动混合,与测定淀粉同样的方法进行操作,并按下式进行计算:
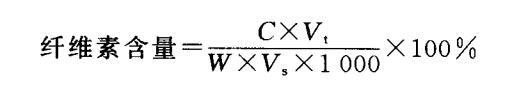
式中,C:从标准曲线上查得样品管中的纤维素含量(μg);其余符号与可溶性糖计算相同。
②重量法:将用丙酮洗涤2次脱脂后的沉淀,在105°C下烘干至恒重w],再将称重后的粗纤维置500°C马弗炉中灰化3 h,冷却后称取恒重(W2)。
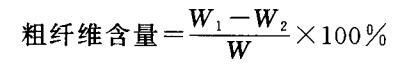
式中,W:样品干重(g) ;W1、W2:分别代表前后两次恒重(g)。
注意事项
1.在测定新鲜样品时,用于提取可溶性总糖的乙醇浓度可以根据材料的含水量换算后适当提高。
2.在可溶性糖(包括淀粉、纤维素)测定中,加人蒽酮-H2SO4试剂必须沿着管壁缓慢进行,以免样品中可溶性糖提前反应显色,影响实验结果。
3.所有样品测定管必须重复3次以上。
独立公正 方法科学 规范严谨 服务周到