果蔬中可溶性糖( soluble sugar)主要是指能溶于水及乙醇的单糖和寡聚糖。果蔬组织中可溶性糖含量的高低与其品质、成熟度和贮藏性密切相关。糖是果蔬组织中重要的能量贮藏物质,也是果蔬甜味的主要来源。糖还是果蔬呼吸作用的主要底物。果蔬在采收以后成为独立的生命个体,不能再从环境中吸收养分和能量。果蔬采后的一切生命活动中所需的能量和中间物质主要来源于果蔬组织中糖类物质的氧化分解过程。因此,测定可溶性糖含量在果蔬品质评价和贮藏保鲜中具有重要意义。
对于可溶性糖的测定方法有很多,大致可分为三类:
①物理法:旋光法、折光法、相对密度法;
②物理化学法:点位法、极谱法、光度法、色谱法;
③化学方法:斐林氏法、高锰酸钾法、碘量法、铁氰化钾法、蒽酮比色法、咔唑比色法等。
在测定其它碳水化合物时,往往通过酸解,使其水解为可溶性的且具有还原性的单糖,再进行测定。因此,可溶性糖和还原糖的测定技术,是研究其它大分子碳水化合物及其代谢相关酶活性和性质的重要方法基础。
苯酚-硫酸法
目的要求
掌握利用苯酚-硫酸法测定果蔬组织中可溶性糖含量的原理和方法。
基本原理
糖在浓硫酸的作用下脱水生成的糖醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物。这种化合物在波长485nm处具有最大吸收峰。在10 ~ 100mg范围内,该橙红色化合物的颜色深浅与糖的含量呈正相关关系,故可通过比色法测定此波长下吸光度值来计算出糖含量。苯酚-硫酸法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,试剂便宜,灵敏度高,实验时基本不受蛋白质存在的影响,并且产生的颜色可稳定160min以上。
材料、仪器及试剂
(一)材料
各种果蔬组织。
(二)仪器及用具
分光光度计水浴锅、具塞刻度试管(25mL)、移液管(10mL)或移液器、研钵、容量瓶(100mL)、滤纸、漏斗、玻璃棒等。
(三)试剂
1、0.09g/mL苯酚溶液
称取90.0g重结晶苯酚,加蒸馏水溶解、稀释至100mL,即为0.9g/mL苯酚溶液,可在室温下保存数月。
取10mL0.9g/mL苯酚溶液,加蒸馏水稀释至100mL,混匀,即为0.09g/mL苯酚溶液,现用现配。
2、浓硫酸(相对密度1.84)
3、100μg/mL 蔗糖标准液
将分析纯蔗糖在80℃下烘至恒重,精确称取1. 000g,加少量蒸馏水溶解,转入到100mL容量瓶中,加入0.5mL浓硫酸,再用蒸馏水定容至刻度,即为0.01g/mL蔗糖标准液。
精确吸取1mL0.01g/mL蔗糖标准液于100mL容量瓶中,加蒸馏水至刻度,摇匀,即为100μg/mL蔗糖标准液。
实验步骤
(一)标准曲线的制作
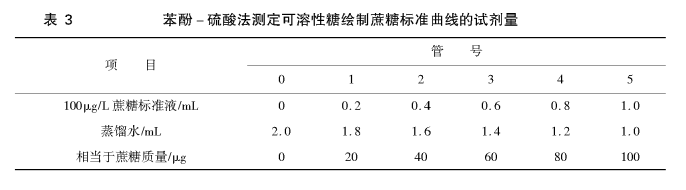
取6支25mL刻度试管(重复做两组),编号后按表3加入100μg/mL蔗糖标准液和蒸馏水。再按顺序向试管内加入1.0mL 90g/L苯酚溶液,摇匀,再从管液正面在5 ~ 20s内加入5mL浓硫酸,摇匀。混合液总体积为8mL,在室温下放置30min进行反应。然后,以空白为参比,在波长485nm处比色测定混合反应液的吸光度值。以蔗糖质量为横坐标,吸光度为纵坐标,绘制标准曲线,求出线性回归方程。
(二)可溶性糖的提取
称取1.0g果蔬组织置于研钵中,研磨呈浆状后,加入少量蒸馏水,转人到刻度试管中,再加人5~10mL蒸馏水,用塑料薄膜封口,于沸水中煮沸提取30min,取出待冷却后过滤,将滤液直接滤人到100mL容量瓶中,再将残渣回收到试管中,加入5 ~ 10mL蒸馏水再煮沸提取10min,并过滤人容量瓶中,用水反复漂洗试管及残渣,过滤后一并转人容量瓶并定容至刻度。
(三)可溶性糖的测定
取1支25mL刻度试管,吸取0.5mL样品液于试管中,加入1.5mL蒸馏水。测定步骤与制作标准曲线相同,按顺序分别加入0.09g/mL苯酚溶液、浓硫酸,显色并测定吸光度值。重复三次。如果吸光度值读数过高,可将样品液稀释后再吸取0.5mL进行反应和测定。
实验结果与计算
1.测定数据记录
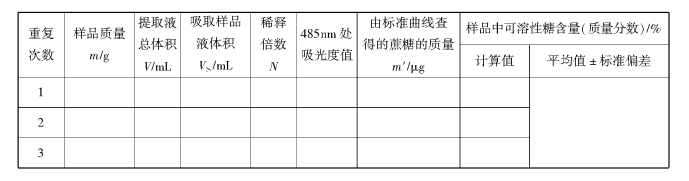
2.计算结果
根据显色液吸光度值,在标准曲线上查出相应的蔗糖质量,按下式计算果蔬组织中可溶性糖含量,以质量分数(% )表示。计算公式:
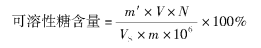
式中 m′——从标准曲线查得的蔗糖质量,μg;
V——样品提取液总体积,mL;
N——样品提取液稀释倍数;
VS——测定时所取样品提取液体积,mL;
m——样品质量,g。
注意事项
(1)由于苯酚-硫酸法测定糖含量是受到多种因素的影响,重现性较差,所以在测定果蔬组织中糖含量时,对操作者要求很高。最好始终--人操作,把每个细节都能固定下来。要尽量多做平行实验,以减少个人操作习惯带来的误差。
(2)利用苯酚-硫酸法测定可溶性糖对苯酚的要求很高。最好利用经过重蒸馏、结晶的苯酚。
(3)浓硫酸的纯度、滴加方式和速度,如直接加在液面上还是慢加等,都会对实验结果产生影响。因此,操作方式一定要一致才能获得较好的重现性。
(4)果实组织糖含量很高,在测定时应注意进行适当的稀释。一般可以取1mL或10mL样品提取液,置于100mL容量瓶中,加蒸馏水稀释至刻度,即将样品液稀释了100倍或10倍。
一般先进行预实验,确定基本的实验条件。一般情况下,反应后的混合液比色时,吸光度值都较高,为了使吸光度值读数处于适当的范围,应对提取液进行稀释,稀释后再进行反应、测定。切忌对反应后的混合液进行稀释。因为在反应后的混合液中硫酸:的浓度很高,稀释反应混合液时一方面会导致溶液放出大量的热,另一方面会导致反应混合液中硫酸浓度降低,引起混合液颜色变化。在浓硫酸作用下,糖醛或羟甲基糠醛才能与苯酚缩合成的化合物呈橙红色(红棕色)。而在稀硫酸中,该化合物的颜色将会发生变化。
此外,稀释过程往往会使实验误差加大。在具体操作时,一定要严谨、认真地进行。
(5)样品中可溶性糖含量的测定过程必须与标准曲线的制作过程相同。
(6)如果样品中含有较多葡萄糖,加热时间应延长至45min,因为葡萄糖显色较慢。
独立公正 方法科学 规范严谨 服务周到