原理
Folin-酚试剂法(福林-酚试剂法)结合了双缩脲试剂和酚试剂与蛋白质的反应,其中包括两步反应:第一步是在碱性条件下,与铜试剂作用生成蛋白质-铜络合物;第二步是此络合物将磷钼酸和磷钨酸试剂(Folin试剂)还原,生成磷钼蓝和磷钨蓝的深蓝色混合物,颜色深浅与蛋白含量成正相关。在650nm比色测定的灵敏度比双缩脲法高100倍。由于肽键显色效果增强,从而减少了因蛋白质种类引起的偏差。该法适用于微量蛋白的测定(氛围为5-100μg蛋白质)。
仪器设备
| 1.722分光光度计。 | 2.定量滤纸。 |
| 3.恒温水浴。 | 4.定量加样器。 |
| 5.冷凝回流装置一套。 | 6.研钵一套。 |
| 7.漏斗。 | 8.刻度移液管。 |
| 9.微量滴定管。 | 10.试管。 |

试剂
1.Folin-酚试剂:由甲、乙两种溶液组成。
甲液:由A、B两种溶液组成。
A液:4%碳酸钠(Na2CO3)溶液与0.2mol•L-1氢氧化钠(NaOH)溶液等体积混合;
B液:1%硫酸铜(CuSO4•5H2O)溶液与2%酒石酸钾钠溶液等体积混合。
每次使用前将A液与B液按50:1的比例混合即成,此试剂只能使用1d,过期失效。
乙液:称取钨酸钠(Na2WO4•2H2O)100g,钼酸钠(Na2MoO4•2H2O)25g,加蒸馏水700mL溶解于1500mL的圆底烧瓶中。之后加入85%的H3PO450mL,浓HCI100mL,安上回流装置(使用磨口接头,若用软木塞或橡皮塞时,就必须用锡纸包起来),使慢慢沸腾10h。冷却后加入硫酸锂(Li2SO4•H2O)150g,蒸馏水50mL,溴水2-3滴打开瓶口煮沸15min,以逐出过量的溴。待冷却后稀释至1000mL,并过滤入棕色瓶中,密闭于冰箱中保存(冷却后溶液呈黄色,若仍呈绿色,须再滴加几滴溴水,继续煮沸15min)。此为Folin-酚试剂乙液,其最终使用浓度相当于1mol•L-1 H+酸。因此在使用前应进行标定。标定方法:取5mL Folin-酚试剂乙液放入锥形瓶内,用1mol•L-1标准NaOH溶液滴定,酚酞作指示剂,当溶液突然转红再转灰绿时,即为滴定终点。计算其相当的酸度,用稀盐酸或稀氢氧化钠溶液调至相当于1mol•L-1 H+酸度。
2.标准蛋白质溶液:称取25mg牛血清清蛋白,溶于100mL蒸馏水中,使终浓度为250μg•mL-1。
3.0.1mol•L-1磷酸缓冲液(pH7.0)。
材料
各种植物材料。
方法步骤
1.标准曲线的绘制
(1)取18mmX200mm试管7支,1-7编号,分别加入0、0.1、0.2、0.4、0.6、0.8、1.0mL标准蛋白质溶液,用蒸馏水补足1mL,使每管含蛋白量分别为0、25、50、100、150、200、250μg•mL-1。
(2)用定量加样器给每支试管中加入5mL甲液,混匀,于30℃下放置10min。
(3)再向试管中喷射加入0.5mL乙液,立即振荡混匀,在30℃下准确保温30min。
(4)以不加标准蛋白的1号管为空白,在650nm下用1cm光径的比色杯测定吸光度。以标准蛋白浓度为横坐标,吸光度为纵坐标,绘制标准曲线或求回归方程。
2.样品的测定:称取鲜样0.8g,用5mL蒸馏水或pH7.0磷酸缓冲液研磨成匀浆后,定容25mL过滤,取滤液1.0mL于试管中,然后重复标准曲线绘制中的2-4步骤,以空白管凋零,测定吸光度。根据吸光度查标准曲线或按回归方程计算,求出样品中的蛋白质含量。
3.结果计算
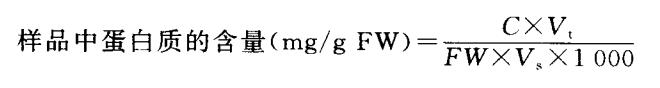
式中,C:查标准曲线值(vg);Vt:提取液总体积(mL);Vs:测定时加样量(mL);FW:样品鲜重(g);1000:将μg换算成mg。
注意事项
1.还原物质、其他酚类物质及柠檬酸对此反应有干扰。
2.因为Folin-酚试剂仅在酸性条件下稳定,但此实验的反应只在pH=10.0的情况下发生,所以当加酚试剂时,必须立即混匀,以便在磷钼酸-磷钨酸试剂被破坏钱即能发生还原反应,否则会使显色程度减弱。
独立公正 方法科学 规范严谨 服务周到

