迄今为止发表的对初级和次级代谢产物最广泛的分析包括53种与植物激素相关的化合物(Schäfer et al., 2016);针对于在植物生长过程中更为集中的关联物质分析包括54种化合物(Cai et al., 2016).相对于初级和次级代谢产物,植物激素在生物内含量具体低浓度的性质,想要进一步扩大单次检测植物激素的检测范围和精确的定量信息需要适当的提高样品制备流程和较高的仪器性能。(Chiwocha et al., 2003; Pan et al., 2008; Kojima et al., 2009; Farrow and Emery, 2012; Cao et al., 2016; Wang et al., 2017)。
本文章提出了一种特殊的方法,旨在提供快速、敏感和同步的功能去鉴定多种植物激素(赤霉素、茉莉酸、水杨酸、脱落酸、吲哚乙酸、玉米素、芸苔素内酯),分析物包括激素的生物活性形式以及它们的前体和代谢物。为了增强痕量化合物的信号,我们提出了一种植物激素组学技术,包括非选择性提取和SPE纯化,然后进行高通量的UHPLC-ESI-MS/MS分离和分析,以分析多种植物激素及其代谢产物,本文所述的植物激素(光敏激素),在仪器分析之前,必须通过特殊的提取物纯化来减少植物基质中存在的大量干扰化合物的影响。该方法在其开发过程中遇到了一些挑战,在试图建立这种技术时应加以考虑。首先,使用合适的萃取溶剂可以最大限度地减少酶的降解,降低干扰物质的含量,以及有效地从植物组织中提取分析物是至关重要的,为了有效地提取目标化合物,并将它们被高温和酶解分解的风险降至最低,样品必须在低于4℃的条件下冷冻(Ljung等,2010)。植物组织首先被均质化,然后用合适的溶剂提取,其中的植物激素是可溶性的且化学性质是稳定的。根据之前发表的关于疏水植物激素(如二萜类气体)分析的若干研究,本文选择冰冷的乙腈(ACN)作为提取溶剂。为了通过信号抑制量化最终的LC-MS/MS分析损伤,实验测定了最丰富的干扰植物色素叶绿素a和叶绿素b的含量。被研究的BRs(以最大信号强度的百分比计算)在50%或更大ACN的溶剂中的溶解度平均达到95%;然而,随着ACN的增加,干扰植物色素的浓度也迅速增加。因此,选择冰冷50% ACN作为最佳提取溶剂,为所选择的植物激素信号强度与叶绿素提取之间最佳的平衡溶度。此外,为了防止ph依赖性水解或其他结构变化发生在提取过程中,实验过程中避免使用酸化溶剂。
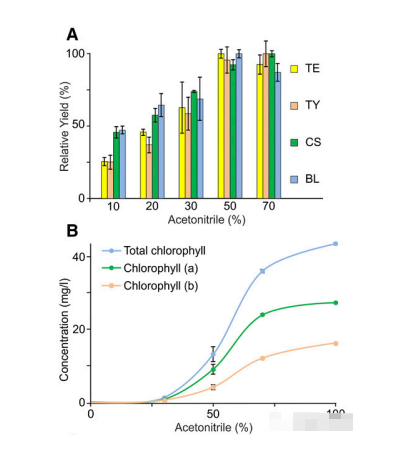
代谢植物的纯化对于高通量分析来说,是需要的,甚至是必需的。无论是具有长18碳烷基链(C18)的硅基RP吸附材料,还是具有离子交换性质的聚合物RP材料(混合模式吸附材料),都已被证明在净化样品和富集目标分析物馏分方面是有效的;(Kojima et al., 2009; Balcke et al., 2012; Floková et al., 2014; Záveská Drábková et al., 2015; Cao et al., 2016; Schäfer et al., 2016).但是使用多步固相萃取的样品制备非常耗时,通常包括几个蒸发步骤,这大大降低了样品制备协议的有效性,特别是对于高度挥发性的化合物,如茉莉酸甲酯或水杨酸甲酯(Floková et al., 2014)。为了避免这些问题,我们使用50% ACN和特殊SPE加载解决方案,这样就消除了一个蒸发步骤,减少了植物基质的影响,并最大限度地减少了酶解和水解造成的损失。以最大效率去除共萃取的植物色素,同时保持高的分析物回收率。并且基于植物激素标准品构建植物激素数据库,对质谱检测的数据进行定性分析。 激素定量是利用PRM分析完成。PRM技术(平行反应监测,Parallel Reaction Monitor )是一种基于高分辨、高精度质谱(如Orbitrap系列)的离子监视技术。
相比于传统的SRM/MRM技术,PRM技术会采集二级信息,使结果更加精确可靠,并且所用的四级杆质量分析器替换为更高分辨、更高质量精度的分析器,实现了从目标离子对检测到全部目标离子碎片检测的转化为了评估这种激素组学方法的实际应用价值,该方法被应用于拟南芥的根、叶和茎组织中的激素鉴定。我们的结果突出了这种分析的价值,它(连同多变量数据分析和转录组数据交叉验证)揭示了拟南芥的激素反应。通过方法学验证植物激素赤霉素、茉莉酸、水杨酸、脱落酸、吲哚乙酸、玉米素、芸苔素内酯的回收率分别为:1.082936、0.945928、0.946618、0.95383、0.962946、0.955238、1.011412;精密度分别为:0.01772、0.01751、0.00871、0.02196、0.01439、0.01429、0.00561。上海液质可以提供最为完整的植物激素检测技术,利用Q-Exactive HF高分辨质谱仪器通过PRM模式分析,能够绝对定量检测18种植物激素:吲哚乙酸、茉莉酸、水杨酸、赤霉素、油菜甾醇内酯、脱落酸、反式玉米素、反式玉米素核苷、玉米素、二氢玉米素、二氢玉米素核苷、玉米素核苷、吲哚乙酰、吲哚乙酸-甘氨酸、吲哚乙酸-谷氨酸、吲哚乙酸-丙氨酸、吲哚乙酸-缬氨酸、吲哚乙酸-亮氨酸;为植物发育、分子遗传和细胞生物学研究提供理想技术平台,在植物代谢领域提供高质量检测服务。
参考文献:Jiskrová E, Novák O, Pospíšilová H, Holubová K, Karády M, Galuszka P, Robert S, Frébort I (2016) Extra- and intracellular distribution of cytokinins in the leaves of monocots and dicots. N Biotechnol 33: 735–742Tarkowská D, Novák O, Oklestkova J, Strnad M (2016) The determination of 22 natural brassinosteroids in a minute sample of plant tissue by UHPLCESI-MS/MS. Anal Bioanal Chem 408: 6799–6812Novák O, Napier R, Ljung K (2017) Zooming in on plant hormone analysis: tissue- and cell-specific approaches. Annu Rev Plant Biol 68: 323–348Wang Q, Cai WJ, Yu L, Ding J, Feng YQ (2017) Comprehensive profiling of phytohormones in honey by sequential liquid-liquid extraction coupled with liquid chromatography-mass spectrometry. J Agric Food Chem 65: 575–585Ryu H, Cho Y (2015) Plant hormones in salt stress tolerance. J Plant Biol 58: 147–155Plačková L, Oklestkova J, Pospíšková K, Poláková K, Buček J, Stýskala J, Zatloukal M, Šafařík I, Zbořil R, Strnad M, (2017) Microscale magnetic microparticle-based immunopurification of cytokinins from Arabidopsis root apex. Plant J 89: 1065–1075
联系我们:400-998-2324
